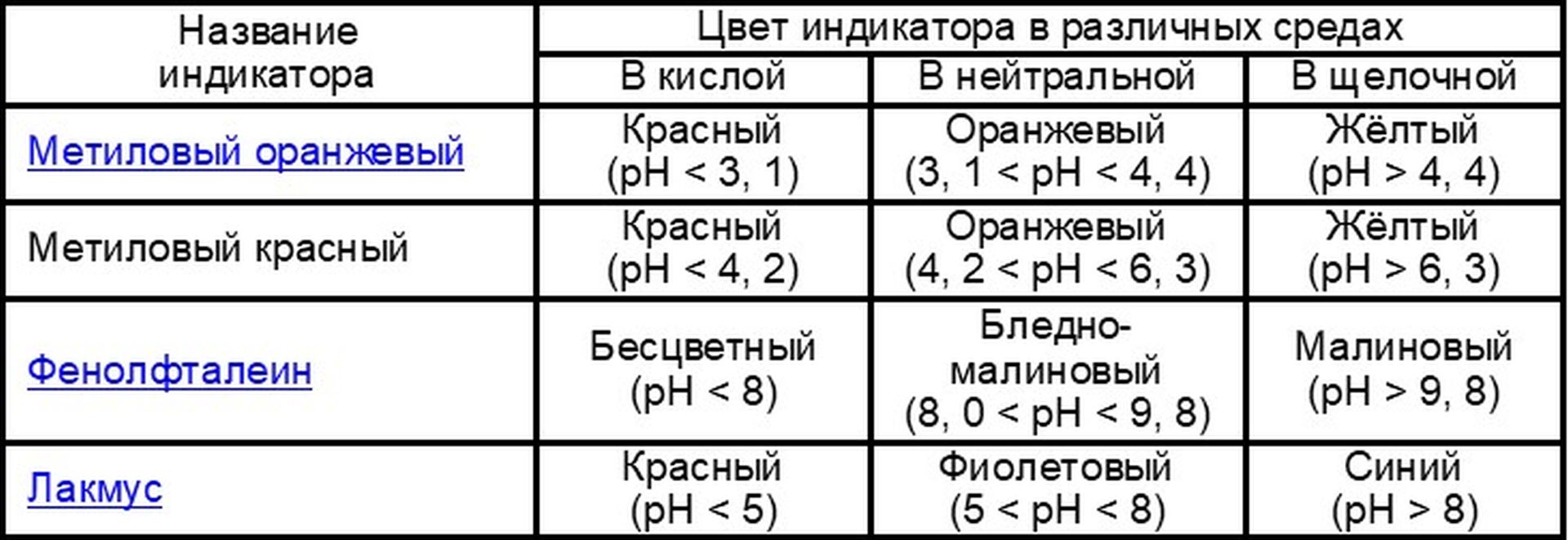
Универсальная индикаторная бумага

Индикаторная бумага в щёлочи и кислоте
Светло-жёлтые полоски индикаторной бумаги в растворе щёлочи приобрели синеватую окраску, а в растворе кислоты — бурую. Индикатор цветовым сигналом отметил разные количества свободных ионов водорода в этих жидкостях.

Приблизительное определение рН растворов с помощью индикаторной бумаги
Полоску индикаторной бумаги обмакнуть в исследуемый раствор, затем быстро положить на белую подложку. Быстро нужно ложить потому, что индикатор растворится в жидкости и бумажка станет белой. Далее сравнить с эталоном цветной шкалы.
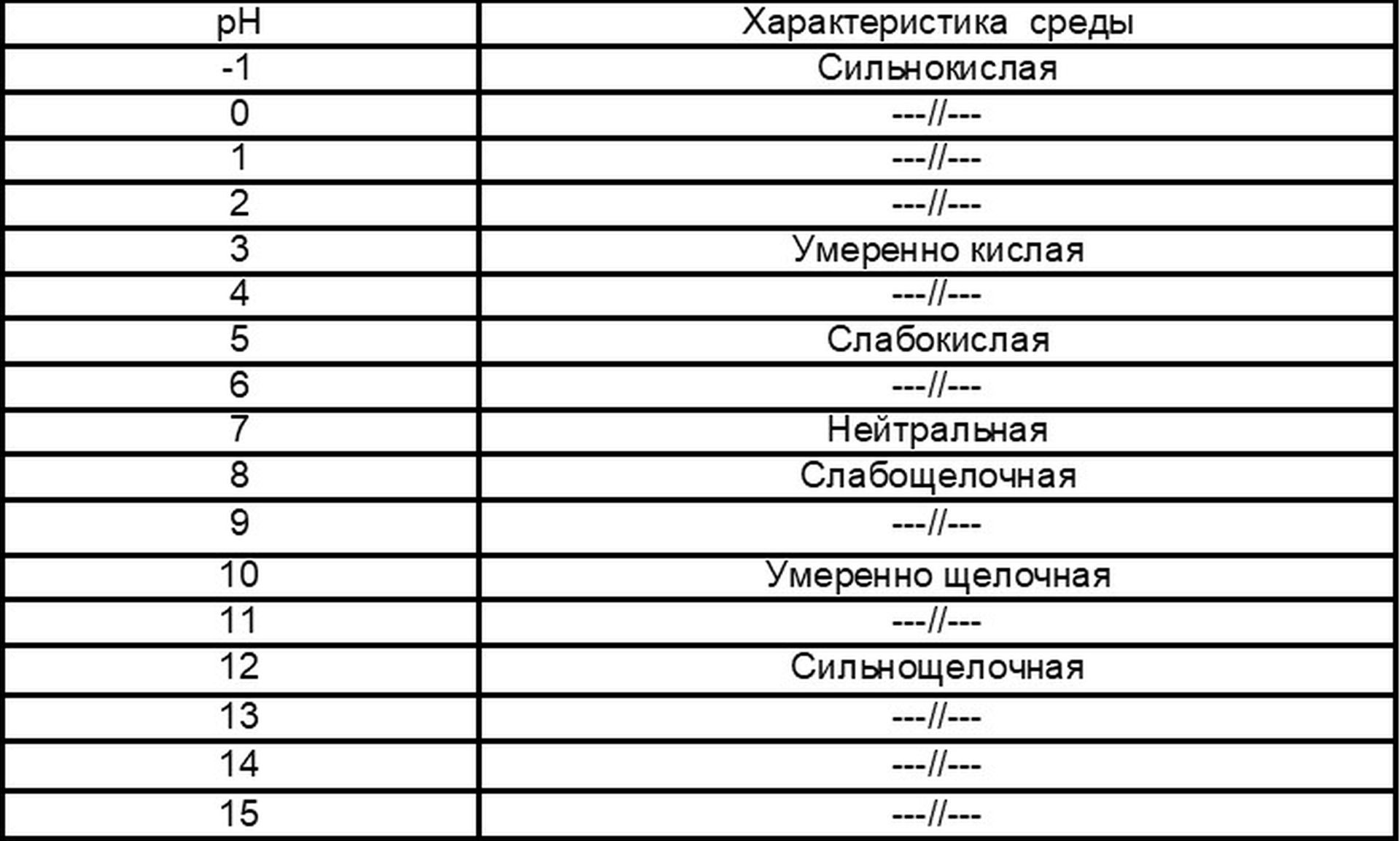
Шкала кислотности растворов
В химии есть вещества, обладающие способностью менять свою окраску в присутствии кислот и щелочей. Эти вещества называются индикаторами и применяются для определения реакционной среды. Среда может быть кислой, щелочной и нейтральной.
Этими веществами пропитывают фильтровальную бумагу. Существует много видов различных индикаторных бумаг (из школы все знают словосочетание «лакмусовая бумажка»), точнее индикаторов, которыми пропитывают бумагу (лакмус, фенолфталеин, метиловый оранжевый и т.д.). Также к индикаторам можно отнести сок красной капусты, вишни и черноплодной рябины. Бумагу пропитывают раствором смеси индикаторов и, поэтому, она окрашивается в разные цвета в разных средах. Для определения кислотности или щелочности среды можно пользоваться бумажкой, пропитанной раствором любого индикатора.
В азотной кислоте бумажка изменила свой цвет на тёмно-красный. Существуют другие кислоты, в которых бумажка меняет свой цвет на красный. Это серная кислота, соляная и др. Эти кислоты называются сильными кислотами. А такие кислоты, как уксусная, лимонная, винная и др., относящиеся, главным образом, к большому классу химических веществ — органических, называются слабыми. В таких кислотах бумажка приобретает розовый цвет.
Значит, с помощью индикаторной бумажки можно определить сильную и слабую кислоту, если они имеют раствор примерно одинаковой концентрации.
В растворе щёлочи бумажка меняет свой цвет на синий. При работе со щелочами соблюдайте осторожность. Не случайно они названы едкими (едкий натр, едкий(-ое) калий(-и)). К щелочам также относятся известковая вода и нашатырный спирт, который неправильно назван «спиртом». Это его бытовое название. Правильно это вещество называется гидроксид аммония.
От щелочей нужно оберегать глаза и руки, они портят краску, оставляют на столе несмываемые пятна.
Кислотность и щелочность растворов выражают через концентрацию ионов Н+. Для удобства оценки в химию введено выражение рН (читается «пэ-аш»). рН называется водородным показателем. Это понятие ввёл датский химик Сёренсен в 1909 году: буква «р» - начальная буква датского слова potenz – математическая степень, буква «Н» - символ водорода.
В нейтральном растворе при 25°С рН = 7. В кислых растворах рН < 7, и тем меньше, чем кислее раствор; в щелочных растворах рН > 7, и тем больше, чем больше щёлочность раствора; другими словами – чем меньше рН, тем больше концентрация ионов Н+, т. е. выше кислотность среды, и наоборот, чем больше рН, тем меньше концентрация ионов Н+, т. е. выше щёлочность среды.
Так, например, у желудочного сока рН 1, 7 (сильнокислая реакция), у дождевой воды рН 6 (слабокислая), у водопроводной воды рН 7, 5 (слабощелочная), у крови рН 7, 4 (слабощелочная), у слюны рН 6, 9 (слабокислая), у слёз и дистиллированной воды рН 7 (нейтральная).
Универсальной индикаторной бумагой пользуются только для приближённого определения значений рН в широких пределах с точностью около одной единицы рН.