
Медный купорос - ярко-синие кристаллы

Медный купорос при нагревании и после него
При нагревании медный купорос теряет воду и превращается в серый порошок. Если после охлаждения накапать на него несколько капель воды, то порошок снова приобретёт синюю окраску.

Медный купорос в серной кислоте
Забрать воду у медного купороса можно также с помощью концентрированной серной кислоты. Кристаллы купороса постепенно опускаются на дно. Некоторые при достижении дна уже потеряли синий цвет.
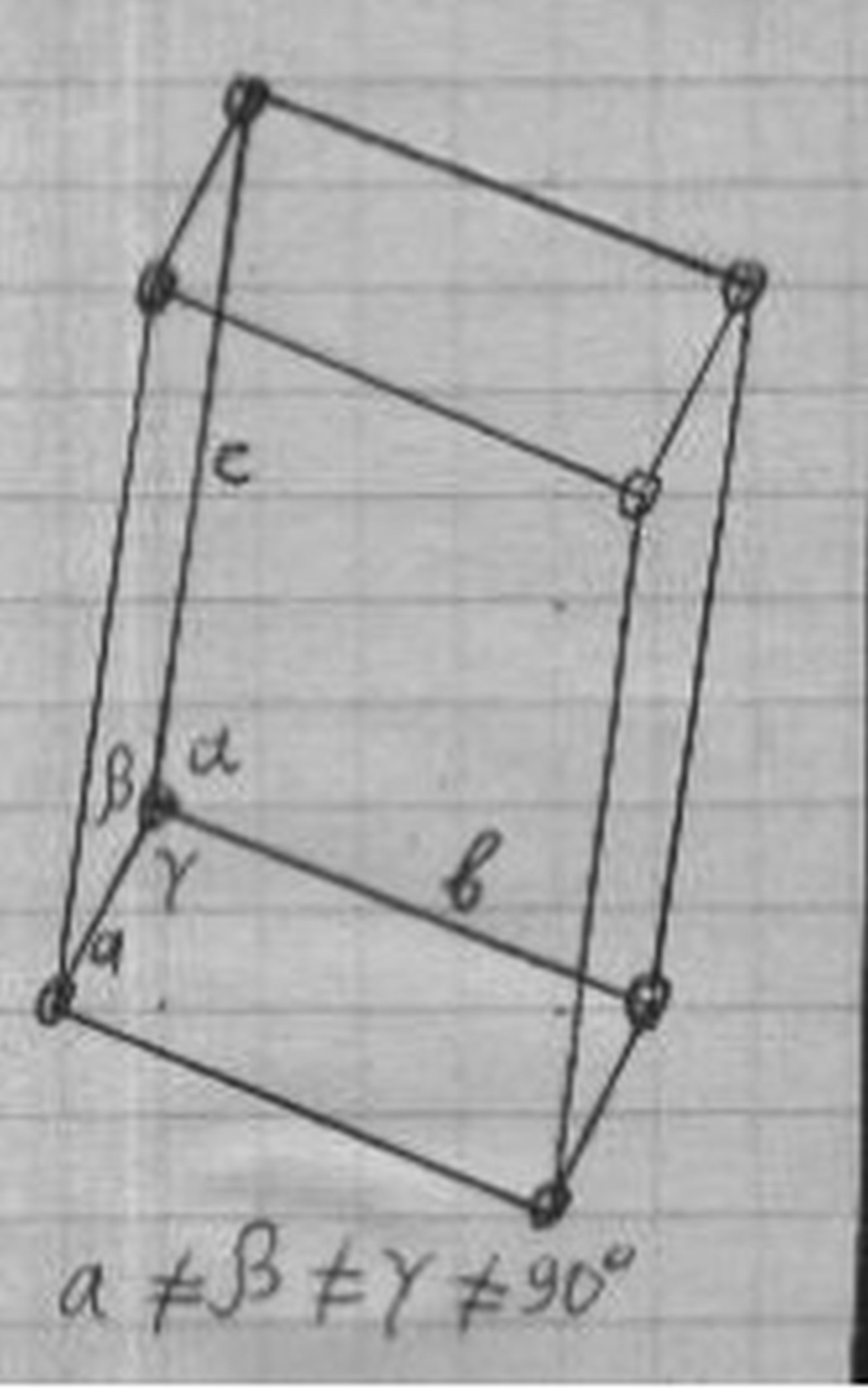
Триклинная решётка кристалла медного купороса
Медный купорос CuSO4 кристаллизуется из водных растворов сульфата меди (см. ниже) и представляет собой ярко-синие кристаллы триклинной системы с параметрами решётки: а = 7, 15 Å, b = 10, 70 Å, с = 5, 97 Å; a = 97°44', β = 125°20', γ = 94°19' ; плотность 2, 29 г/см3.
При нагревании выше 105°С плавится с потерей части кристаллизационной воды и переходит CuSO4 . 3Н2О (голубого цвета) и CuSO4 . Н2О (белого цвета). Полностью обезвоживается при температуре 258°С. При действии сухого NH3 на CuSO4 образуется CuSO4 . 5NH3, обменивающий во влажном воздухе NH3 на Н2О. С сульфатами щелочных металлов CuSO4 образует двойные соли типа Me2SO4 . CuSO4 . 6H2O, окрашенные в зеленоватый цвет.
В промышленности медный купорос получается растворением металлической меди в нагретой разбавленной H2SO4 при продувании воздуха: Cu + H2SO4 + ½O2 = CuSO4 + H2O. Он является также побочным продуктом электролитического рафинирования меди.
Медный купорос — самая важная техническая соль меди. Он применяется при получении минеральных красок, пропитке древесины, для борьбы с вредителями и болезнями растений в сельском хозяйстве, для протравливания зерна, при выделке кож, в медицине, в гальванических элементах; служит исходным продуктом для получения других соединений меди.
Сульфат меди (сернокислая медь) CuSO4 — бесцветные кристаллы плотностью 3, 64 г/см3. При нагревании диссоциирует: CuSO4 = CuO + SO2 + ½O2 с образованием в качестве промежуточного продукта основного сульфата CuO . CuSO4. При 766°С давление диссоциации CuSO4 достигает 287 мм ртутного столба, а CuO . CuSO4 — 84 мм ртутного столба. Растворимость CuSO4 в граммах на 100 г воды составляет: 14 (0°С); 23, 05 (25°С); 73, 6 (100°С). В присутствии свободной H2SO4 растворимость понижается. При рН 5, 4 — 6, 9 CuSO4 гидролизуется с образованием основных солей. CuSO4 очень гигроскопична, поэтому применяется как осушающее вещество; присоединяя воду, синеет, что иногда используется для обнаружения воды в спирте, эфире и других.