
Уксусная кислота

Уксус — 9%-ная уксусная кислота
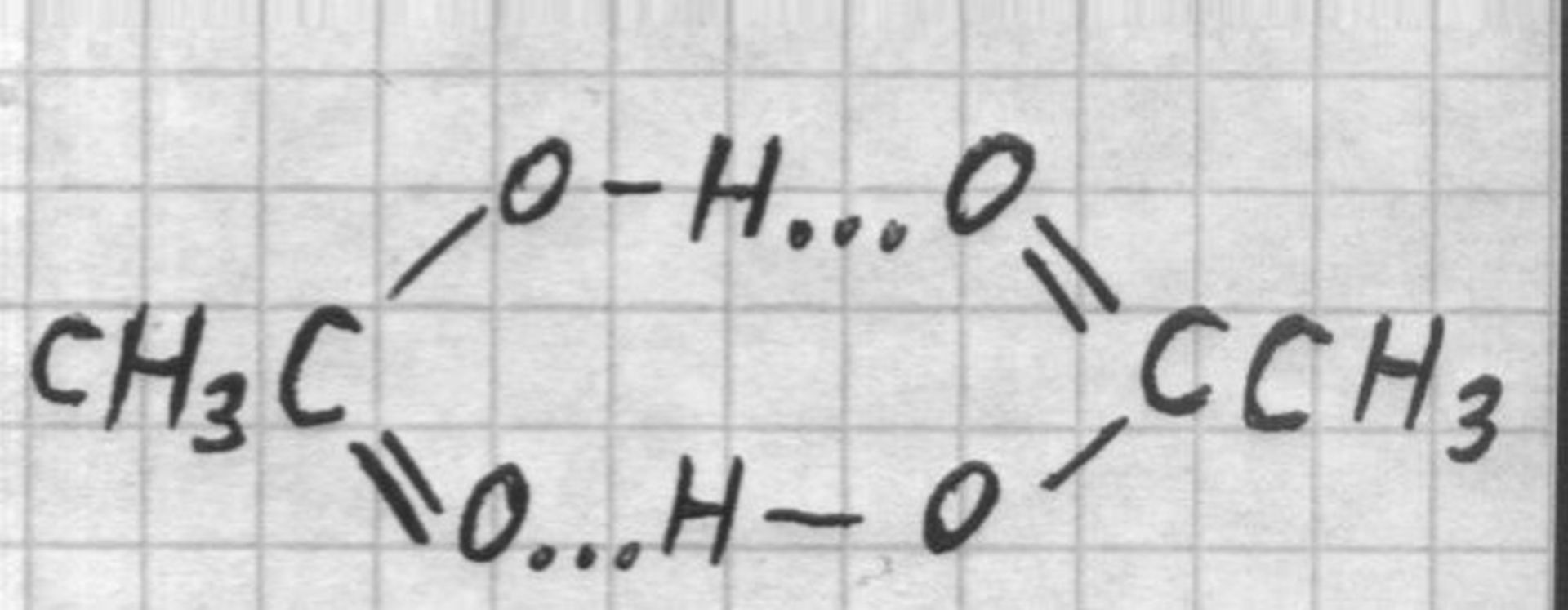
«Ледяная» уксусная кислота образует за счёт водородных связей устойчивые до 250°С димеры
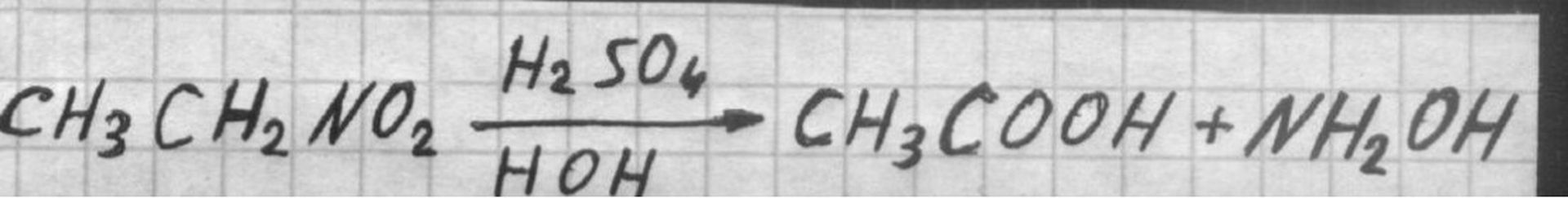
Действие серной кислоты на нитроэтан
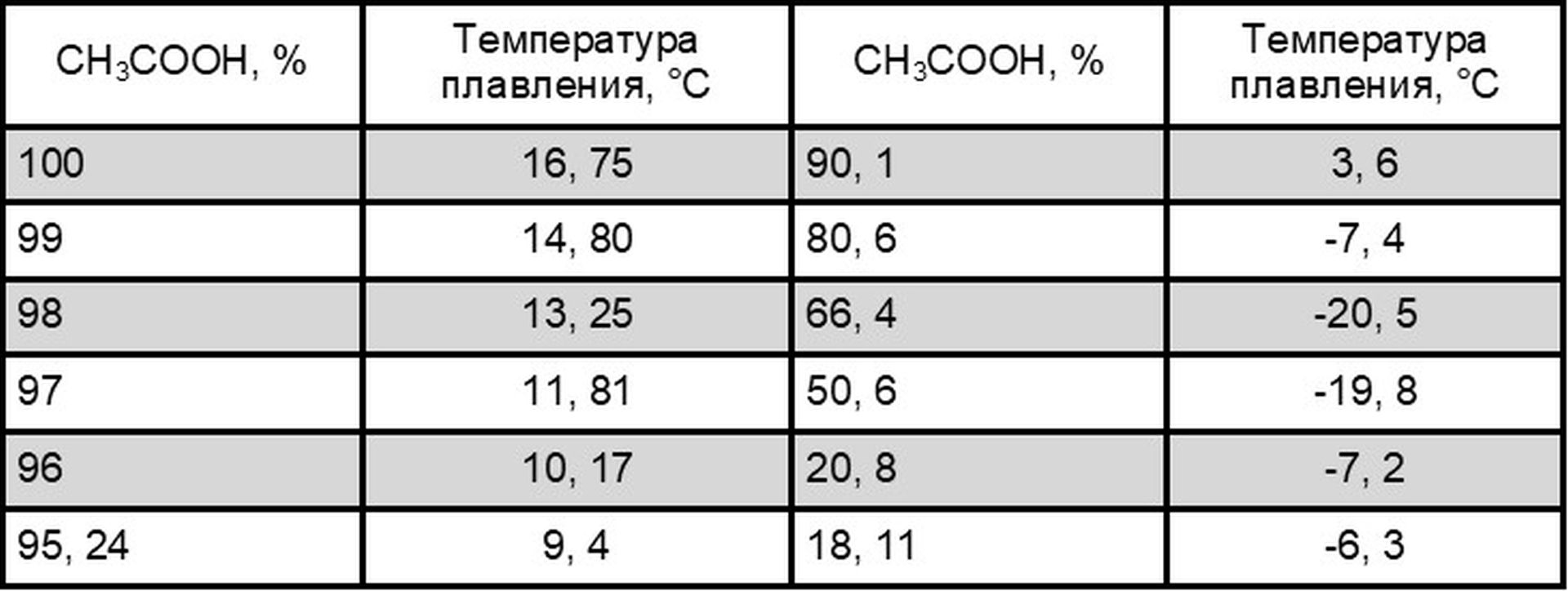
Температуры плавления водных растворов уксусной кислоты
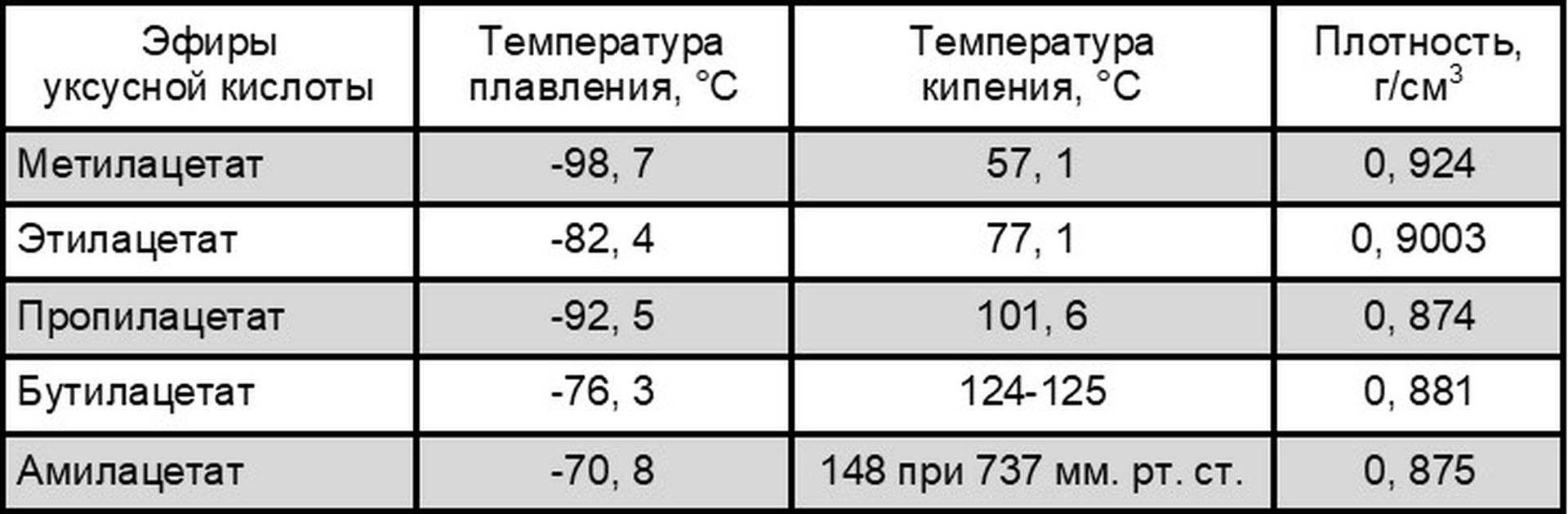
Физические свойства некоторых эфиров уксусной кислоты
Уксусная кислота (метанкарбоновая, этановая кислота) CH3COOH — бесцветная жидкость с резким запахом и кислым вкусом. Безводную уксусную кислоту называют «ледяной». Температура плавления составляет 16, 75°С, температура кипения 118, 1°; 17, 1° при давлении 10 мм. рт. столба, 42, 4° при 40 мм., 62, 2° при 100 мм., 98, 1° при 400 мм. и 109° при 560 мм. ртутного столба.
Удельная теплоёмкость уксусной кислоты равна 0, 480 кал/г . град., Qсгорания 209, 4 ккал/моль.
Уксусная кислота принадлежит к слабым кислотам, константа диссоциации К = 1, 75 . 10-5 . Она во всех отношениях смешивается с водой, спиртом, эфиром, бензолом и нерастворима в сероуглероде. При разбавлении уксусной кислоты водой происходит сокращение объёма раствора. Максимальная плотность 1, 0748 г/см3 отвечает моногидрату.
Уксусная кислота — первая из кислот, которая стала известна человечеству (в виде уксуса, образующегося при скисании вина). В концентрированном виде она получена Шталем в 1700 году, а состав установлен Берцелиусом в 1814 году. Уксусная кислота распространена в растениях как в свободном виде, так и в виде солей и сложных эфиров; она образуется при гниении и брожении молочных продуктов. Превращение спиртовых жидкостей в уксус (3-15% уксусная кислота) происходит под действием бактерий «уксусного грибка» Micoderma aceti. Из перебродившей жидкости перегонкой получают 80% уксусную кислоту — уксусную эссенцию. Уксусную кислоту в ограниченном масштабе получают из «древесного уксуса» - одного из продуктов сухой перегонки древесины.
Основной промышленный метод получения уксусной кислоты состоит в окислении ацетальдегида, синтезируемого из ацетилена по Кучерова реакции. Окисление производят воздухом или кислородом при 60° и катализе (СН3СОС)2Мn. Таким способом получают 95-97% уксусную кислоту. В присутствии ацетатов кобальта и меди при 40° получают смесь уксусной кислоты (50-55%), уксусного ангидрида (30-35%) и воды (~10%). Смесь разделяют перегонкой. Техническое значение для получения уксусной кислоты имеет также окисление этилена, этилового спирта и других, а также действие серной кислоты на нитроэтан.
Чистую уксусную кислоту получают из технических продуктов ректификацией.
Гидроксильная группа уксусной кислоты очень реакционноспособна и может обмениваться на галогены, SH, OC2H5, NH2, NHNH2, N3, NHOH и другие с образованием разных её производных, например, ацетила хлористого СН3СОСl, уксусного ангидрида (CH3CO)2O, ацетамида СН3СОNН2, азида СН3СОN3; спиртами уксусная кислота этерифицируется, образуя сложные эфиры (ацетаты) СН3СООR, простейшие из которых — легколетучие жидкости с фруктовым запахом (например, амилацетат и изоамилацетат «грушевая эссенция»), реже с цветочным запахом (трет-Бутилциклогексилацетат).
Физические свойства некоторых эфиров уксусной кислоты приведены в таблице; их широко применяют как растворители (особенно этилацетат) для нитроцеллюлозных лаков, глифталевых и полиэфирных смол, в производстве киноплёнки и целлулоида, а также в пищевой промышленности и парфюмерии. В производстве полимеров значительную роль играют искусственные волокна, лаки и клеи на основе винилацетата.
Уксусная кислота находит обширное и разнообразное применение. В технике к числу её наиболее распространённых реакций относится введение ацетильной группы СН3СО, с помощью которой защищают, например, в ароматических аминах NH2-группу от окисления при нитровании; получают ряд лекарственных веществ (аспирин, фенацетин и другие).
Значительные количества уксусной кислоты идут на производство ацетона, ацетилцеллюлозы, синтетических красителей, используются при крашении и печатании тканей и в пищевой промышленности. Основные соли уксусной кислоты Al, Fe, Cr и другие служат протравами при крашении; они обеспечивают прочную связь красителя с текстильным волокном.
Пары уксусной кислоты раздражают слизистые оболочки верхних дыхательных путей. Хроническое действие паров ведёт к заболеваниям носоглотки и к конъюнктивитам. Предельно допустимая концентрация её паров в воздухе 0,005 мг/л. Растворы с концентрацией выше 30% вызывают ожоги.