
Железный купорос - голубовато-зелёные кристаллы

На воздухе выветривается и окисляется, окрашиваясь в жёлтый цвет

Сделаем надпись на бумаге раствором железного купороса; когда надпись высохнет, проведём ваткой, смоченной в растворе красной кровяной соли (калия железосинеродистого) по этому месту, и появится надпись синего цвета
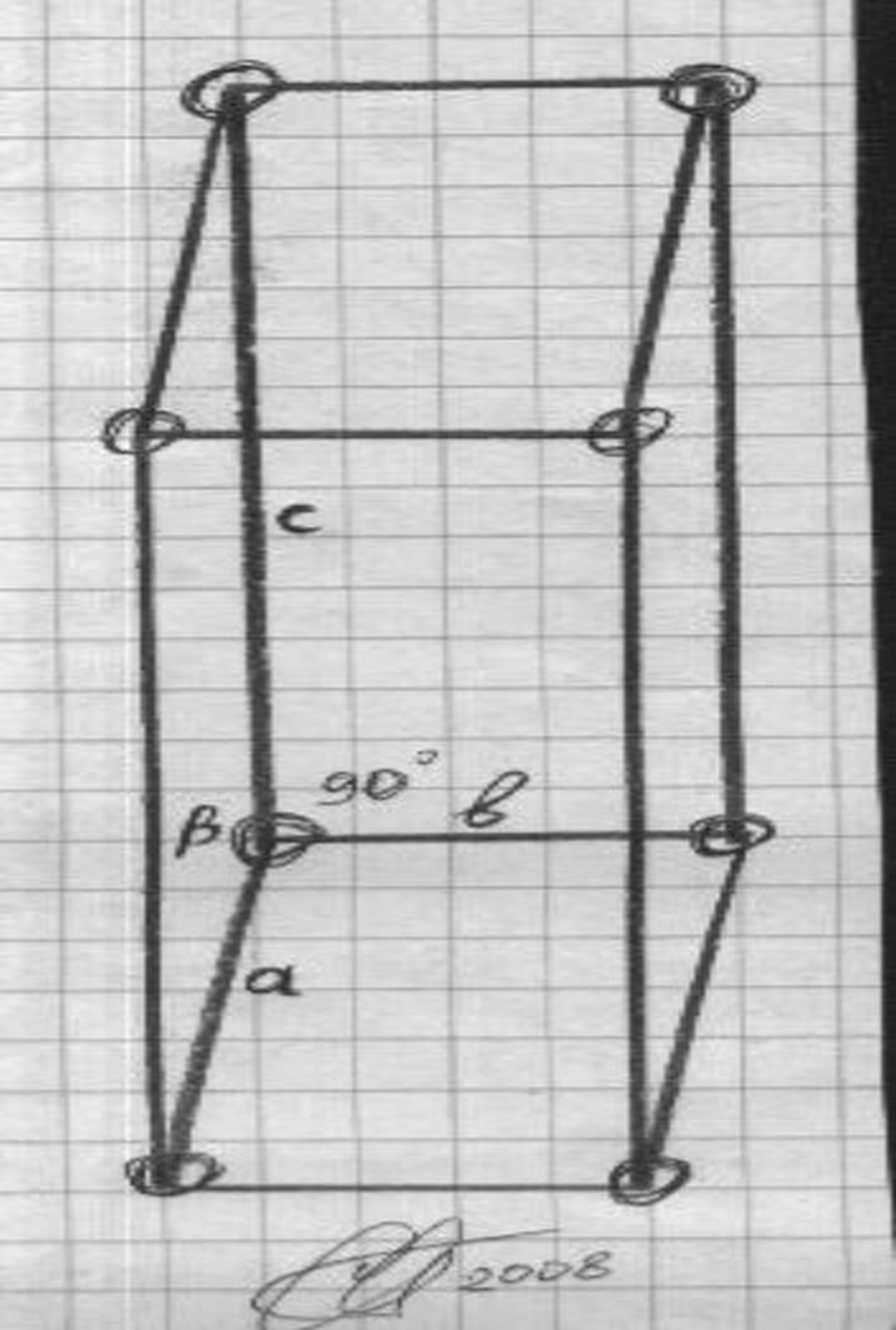
Моноклинная решётка кристалла железного купороса
Сульфат двухвалентного железа (ферросульфат) FeSO4 кристаллизуется из водных растворов в форме FeSO4 . 7H2O и называется в технике железным купоросом (или зелёным купоросом).
FeSO4 . 7H2O — голубовато-зелёные моноклинные кристаллы (см. рис.) с параметрами решётки: а = 14, 02 Å, b = 6, 50 Å, с = 11, 01 Å, β = 105°34' , плотностью 1, 899 г/см3 при 15°С. На воздухе выветривается и окисляется, окрашиваясь в жёлтый цвет вследствие образования на поверхности Fe(OH)SO4. От 56, 8°С до 64°С стабильный FeSO4 . 4H2O — зелёного цвета, выше 64°С — белый FeSO4 . H2O. Он полностью обезвоживается при 300°С, разлагаясь при этом с выделением SO2 , SO3 и образованием основного сульфата окиси железа. Безводный FeSO4 — белый порошок, может быть получен обезвоживанием кристаллогидратов в потоке Н2.
В отсутствии кислорода FeSO4 разлагается с достаточно большой интенсивностью и полнотой при 700°С; в потоке воздуха его разложение значительно ускоряется в присутствии восстановителей — угля и пирита (смесь из 82, 3% FeSO4 . H2O, 15, 2% FeS2 и 2, 5% угля разлагается в потоке воздуха при 600°С за 40-60 мин. на 98%).
Растворимость в воде (в %) в расчёте на безводную соль: 14, 91 (при –1, 8°С); 21, 01 (при 20°С); 35, 06 (при 56, 7°С); 35, 57 (при 64°С); 27, 15 (при 90, 1°С). В присутствии свободной H2SO4 растворимость уменьшается. В водном растворе FeSO4 гидролизуется с выделением осадка основной соли, а в присутствии кислорода окисляется до Fe2(SO4)3. Также в водном растворе FeSO4 восстанавливает Cu (II) до солей Cu (I), соли золота и серебра — до металлов; нитраты и нитриты — до NO, с которым FeSO4 образует окрашенный комплекс FeSO4 . NO (качественная реакция на ионы NO-3 и NO-2). Восстановление перманганата или бихромата калия раствором FeSO4 в присутствии H2SO4 используется для количественного определения железа. Сульфат двухвалентного железа образует с сульфатами щелочных металлов и аммония двойные соли, более стойкие против окисления, например, соль Мора (NH4)2SO4 . FeSO4 . 6H2O — светло-зелёные кристаллы, растворимые в воде.
В промышленности железный купорос производится как побочный продукт на металлообрабатывающих заводах из травильных растворов, которые получаются при обработке стальных изделий с целью удаления с них окалины перед дальнейшей обработкой поверхности.
Кристаллический железный купорос может быть выделен из травильных растворов при охлаждении их до –5°С, -10°С или выпариванием с последующей кристаллизацией при охлаждении до 20-25°С.
Железный купорос используют для борьбы с вредителями садов и слизнями, для уничтожения мхов, лишайников и грибных спор, а также для питания растений и борьбы с засолением почв; его применяют также в текстильной промышленности, для приготовления чернил и минеральных красок, для консервации древесины, как реактив в химических лабораториях и т.д.
Отбросные растворы сульфатов железа перерабатывают на изоляционный материал — феррон или ферригипс, представляющий собой смесь гидратов окислов железа и гипса с наполнителем.
При работе с железным купоросом в помещении появляется специфический запах; к тому же, если работать с ним голыми руками, то при попадании на порез кожи может причинить боль.
Соль Мора используют в аналитической химии как восстановитель.