
Кусочек копчёной колбасы содержит столько фенольных соединений, сколько человек вдыхает в городе за год
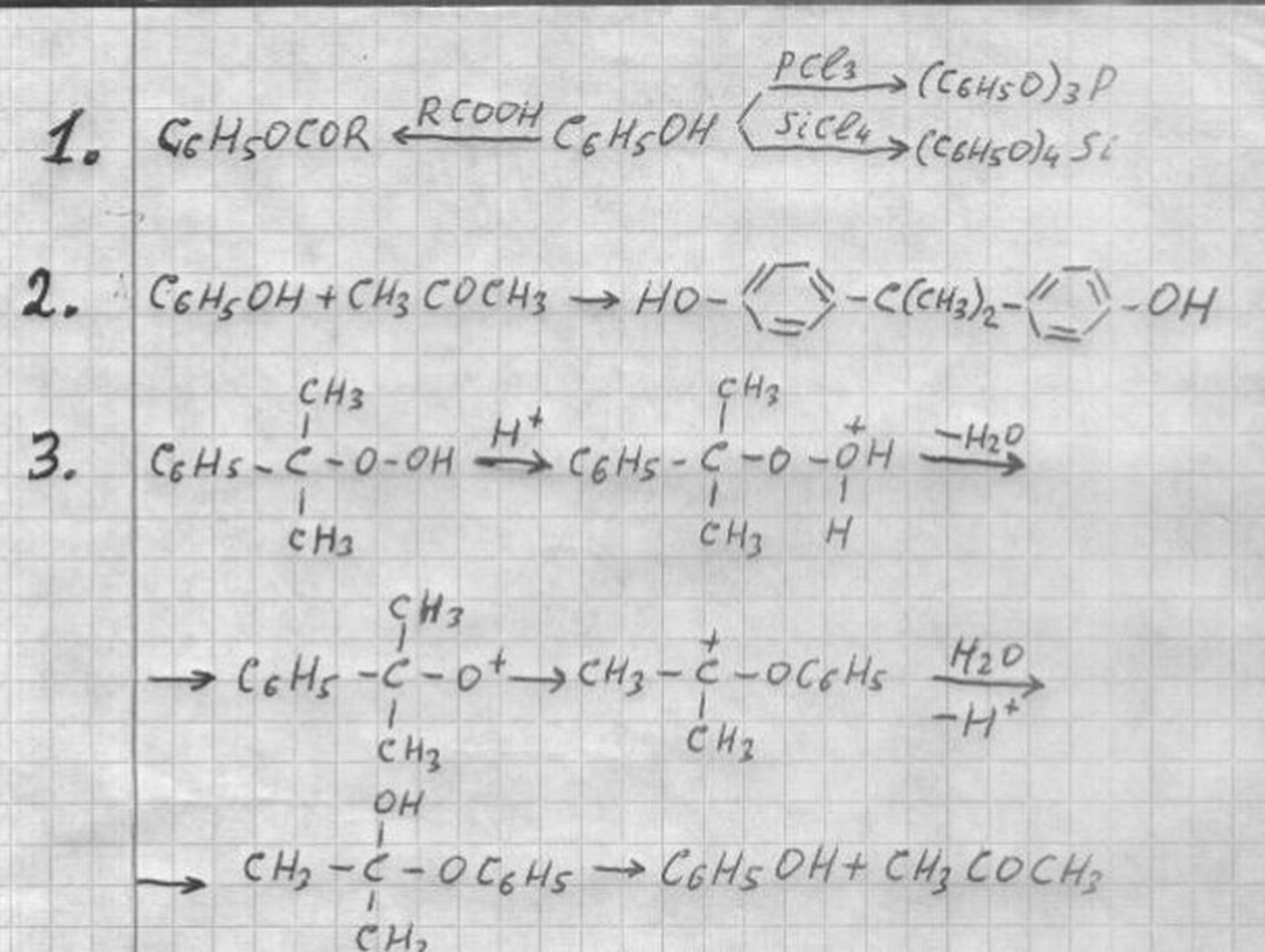
Формулы фенол
Фенол (оксибензол, карболовая кислота) C6H5OH — бесцветные розовеющие при хранении кристаллы с характерным запахом: температура плавления 40, 9°; температура кипения 181, 75°, 120, 2°/100 мм, 73, 5°/10 мм; теплота плавления 28, 6 кал/г, скрытая теплота испарения 117, 7 кал/г (100°), 103, 4 кал/г (182°); образует азеотропные смеси: с водой (9, 2% фенола, температура кипения 99, 6°), кумолом (37% фенола, температура кипения 170, 5°), октанолом (13% фенола, температура кипения 194, 4°), циклогексанолом (87% фенола, температура кипения 183°), анилином (42% фенола, температура кипения 186, 2°).
Фенол хорошо растворим в спирте, эфире, ацетоне, хлороформе; в 100 граммах воды при 15° растворяется 8, 2 грамма фенола, критическая температура взаимной растворимости в системе фенол-вода 65, 85°. Фенилбензоат, температура плавления 71°; 2, 4, 6-трибромфенол, температура плавления 96°; дифенилуретан, температура плавления 104-105°.
Фенол обладает слабокислотными свойствами. При действии щелочей он образует феноляты. При комнатной температуре фенолят натрия образует с CO2 натриевую соль фенилугольной кислоты, которая при нагревании перегруппировывается в салицилат натрия (Кольбе-Шмидта реакция):
C6H5ONa + CO2 → C6H5OCOONa → (120-140°C) C6H4(OH)COONa.
Сложные эфиры карбоновых кислот удобно получать этерификацией фенола кислотами. Сложные эфиры минеральных кислот синтезируют из соответствующих хлорангидридов и фенола, например, см. формулу 1.
Фенол вступает в реакции электрофильного замещения: с бромом получается главным образом 2, 4, 6-трибромфенол, нитрованием концентрированной HNO3 — пикриновая кислота (тринитрофенол), нитрозированием — n-нитрозофенол, действием H2SO4 — смесь o- и n-фенолсульфокислот, реакцией с алкилгалогенидами, спиртами или олефинами в присутствии кислотных катализаторов образуются алкилфенолы.
С ацетоном фенол превращается в дифенилолпропан (см. формула 2).
Фталевый ангидрид конденсируется с фенолом, образуя фенолфталеин. С формальдегидом фенол даёт смолы феноло-формальдегидные. При кипячении фенола с цинковой пылью он восстанавливается в бензол. При гидрировании фенола над никелем образуется циклогексанол (часто с примесью циклогексанона). Окисление фенола приводит к разным продуктам в зависимости от окислителя и условий реакции.
Метод промышленного синтеза фенола основан на расщеплении кислотами гидроперекиси изопропилбензола; продуктами реакции являются фенол и ацетон (П. Г. Сергеев, Р. Ю. Удрис, Б. Д. Кружалов, формула 3).
Кроме того, фенол получают сплавлением фенолсульфокислого натрия с едким натром:
C6H5SO2ONa + 2NaOH → C6H5ONa + Na2SO3 + H2O,
а также гидролизом хлорбензола в жидкой фазе при 300° и давлении 200-280 атмосфер в присутствии щелочей или в паровой фазе при 420° над окисью алюминия.
Некоторое значение имеет получение фенола окислением бензола и толуола. Фенол также выделяют из каменноугольной смолы.
Фенол применяют в производстве феноло-формальдегидных смол, капролактама, пикриновой кислоты, разнообразных красителей и пестицидов, лекарственных веществ, например, салициловой кислоты, салола, аспирина. Из фенола готовят алкилфенолы, которые служат присадками к бензинам и маслам; на их основе также производят поверхностно-активные вещества. Фенол применяют и как антисептик.
Качественные реакции на фенол: с раствором хлорного железа — фиолетовое окрашивание, исчезающее при подкислении; при действии бромной воды — образование белого осадка трибромфенола; с гипохлоритом натрия в растворе аммиака — синяя окраска, переходящая в ярко-красную при подкислении соляной кислотой. Для количественного определения фенола используют йодометрию и бромометрию.
При попадании фенола на кожу он вызывает местные «ожоговые» явления; при длительном контакте и поражении 0, 5 - 0, 25 поверхности тела —смертельный исход. Предельно допустимая концентрация в воздухе 0, 005 мг/л.
Фенол находится во многих промышленных сточных водах (производства пластмасс, коксохимических заводов, анилинокрасочных и других); предельно допустимая концентрация фенолов в местах водопользования 0, 001 - 0, 002 мг/л.